Introducción a las proteínas y los aminoácidos
Diferentes tipos de proteínas. Estructura y propiedades de los aminoácidos. Formación de enlaces peptídicos.
Introducción
Tendemos
a pensar en las proteínas como un sustantivo incontable: una sustancia
homogénea, algo que debería estar en tu dieta en cierta cantidad. Sin
embargo, si alguna vez trabajas en un laboratorio de biología molecular
(por ejemplo, durante unas prácticas en el verano), ya no pensarás lo
mismo.
¿Cómo
es posible? Tú mismo comprobarás que las proteínas no son simplemente
una sustancia, sino que hay muchísimas proteínas diferentes en un
organismo o incluso en una sola célula. Además, son de todos los
tamaños, formas y tipos que puedas imaginar, y cada una tiene una
función única y específica. Algunas son componentes estructurales que le
dan forma a las células o las ayudan a moverse. Otras actúan como
señales, yendo y viniendo entre las células como mensajes en una
botella. Otras son enzimas metabólicas que unen o rompen biomoléculas
necesarias para las células. ¡Lo más probable es que durante tu
investigación uno de estos actores moleculares únicos se vuelva tuyo!
Las
proteínas son una de las moléculas orgánicas más abundantes en los
sistemas vivos y son mucho más diversas en estructura y función que
otras clases de macromoléculas. Una sola célula puede contener miles de
proteínas, cada una con una función única. Aunque tanto sus estructuras
como sus funciones varían mucho, todas las proteínas se componen de una o
más cadenas de aminoácidos. En este artículo veremos con más detalle
los componentes, las estructuras y las funciones de las proteínas.
Tipos de proteínas y sus funciones
Las
proteínas pueden desempeñar una amplia gama de funciones en una célula u
organismo. Aquí veremos unos cuantos ejemplos de proteínas comunes que
pueden ser familiares para ti y que son importantes en la biología de
muchos organismos (incluyéndonos a nosotros).
Enzimas
Las enzimas
actúan como catalizadores en las reacciones bioquímicas (es decir, las
aceleran). Cada enzima reconoce uno o más sustratos, las moléculas que
sirven como material de partida para la reacción que cataliza.
Diferentes enzimas participan en distintos tipos de reacciones y pueden
descomponer, unir o reorganizar sus sustratos.
Un
ejemplo de una enzima que se encuentra en tu cuerpo es la amilasa
salival, que descompone la amilosa (un tipo de almidón) en azúcares más
pequeños. La amilosa no tiene un sabor muy dulce, pero los azúcares más
pequeños sí. Es por eso que los alimentos con almidón son más dulces si
los masticas por más tiempo: le estás dando tiempo a la amilasa salival
de hacer su trabajo.
Hormonas
Las hormonas
son señales químicas de larga distancia liberadas por las células
endocrinas (como las de la glándula pituitaria) que controlan procesos
fisiológicos específicos, tales como el crecimiento, desarrollo,
metabolismo y reproducción. Mientras que algunas hormonas se basan en
esteroides (ve el artículo sobre lípidos), otras son proteínas. Estas hormonas basadas en proteínas se llaman hormonas peptídicas.
Por
ejemplo, la insulina es una hormona peptídica importante que ayuda a
regular los niveles de glucemia. Cuando estos se elevan (después de
comer, por ejemplo), células pancreáticas especializadas liberan
insulina, la cual se une a las células del hígado y de otras partes del
cuerpo para absorber la glucosa. Este proceso permite que la glucemia
vuelva a sus niveles normales en reposo.
En la siguiente tabla se enumeran algunos tipos adicionales de proteínas y sus funciones:
Tipos de proteínas y sus funciones
| Función | Ejemplos | Funciones |
|---|---|---|
| Enzima digestiva | Amilasa, lipasa, pepsina | Degrada los nutrientes en los alimentos en trozos más pequeños que pueden ser absorbidos fácilmente |
| Transporte | Hemoglobina | Transporta sustancias por el cuerpo en la sangre o linfa |
| Estructura | Actina, tubulina, queratina | Forma diferentes estructuras, como el citoesqueleto |
| Señalización hormonal | Insulina, glucagón | Coordina la actividad de diferentes sistemas del cuerpo |
| Defensa | Anticuerpos | Protege el cuerpo de patógenos externos |
| Contracción | Miosina | Lleva a cabo la contracción muscular |
| Almacenamiento | Proteínas de almacenamiento en verduras, clara de huevo (albúmina) | Proporciona alimento para el desarrollo temprano del embrión o la plántula |
Tabla modificada de OpenStax College, Biología.
Las
proteínas tienen muchas formas y tamaños diferentes. Algunas son
globulares (casi esféricas), mientras que otras forman fibras largas y
delgadas. Por ejemplo, la hemoglobina (la proteína que transporta el
oxígeno en la sangre) es una proteína globular, mientras que el colágeno
(que se encuentra en la piel) es una proteína fibrosa.
La
forma de una proteína es esencial para su función y, como veremos en el
siguiente artículo, muchos tipos diferentes de enlaces químicos pueden
ser importantes para mantener su forma. Los cambios en la temperatura y
el pH, así como la presencia de ciertos químicos, pueden alterar la
forma de una proteína y provocar que pierda su funcionalidad, un proceso
conocido como desnaturalización.
Aminoácidos
Los aminoácidos
son los monómeros que componen las proteínas. Específicamente, una
proteína está compuesta de una o más cadenas lineales de aminoácidos,
cada una de la cuales se denomina polipéptido (más adelante veremos de dónde proviene este nombre). Las proteínas contienen 2020 tipos de aminoácidos.
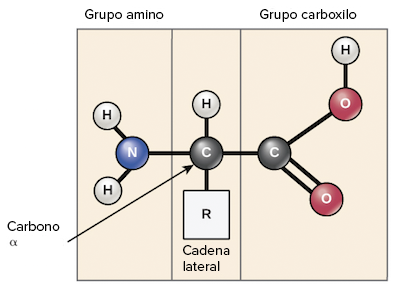
Los
aminoácidos comparten una estructura básica que consiste en un átomo
central de carbono, también llamado carbono alfa (α), unido a un grupo
amino (NH2N, H, start subscript, 2, end subscript), un grupo carboxilo (COOHC, O, O, H) y un átomo de hidrógeno.
Aunque
los aminoácidos generalizados que se ilustran arriba presentan sus
grupos amino y carboxilo como neutrales para simplificar, en realidad no
es el estado en el que se encuentran normalmente. A pH fisiológico (7.27, point, 2 - 7.47, point, 4),
el grupo amino generalmente se encuentra protonado y tiene una carga
positiva, mientras que el grupo carboxilo está desprotonado y tiene una
carga negativa.
Cada
aminoácido también tiene otro átomo o grupo de átomos unidos al átomo
central, conocido como el grupo R, que determina la identidad del
aminoácido. Por ejemplo, si el grupo R es un átomo de hidrógeno, el
aminoácido es glicina, mientras que si es un grupo metilo (CH3C, H, start subscript, 3, end subscript), el aminoácido es alanina. Los 20 aminoácidos comunes se muestran en la tabla siguiente, con sus grupos R resaltados en azul.
Las
propiedades de la cadena lateral determinan el comportamiento químico
de un aminoácido (es decir, si se considera ácido, básico, polar o no
polar). Por ejemplo, los aminoácidos como la valina y la leucina son no
polares e hidrofóbicos, mientras que los aminoácidos como la serina y la
glutamina tienen cadenas laterales hidrofílicas y son polares. Algunos
aminoácidos, como la lisina y la arginina, tienen cadenas laterales que
están cargadas positivamente a pH fisiológico y se consideran
aminoácidos básicos. (La histidina a veces se considera dentro de este
grupo también, aunque está mayoritariamente desprotonada a pH
fisiológico.) El aspartato y el glutamato, por el contrario, están
cargados negativamente a pH fisiológico y se consideran ácidos.
Algunos
otros aminoácidos tienen grupos R con propiedades especiales, las
cuales demostrarán su importancia cuando veamos la estructura de las
proteínas:
- La prolina tiene un grupo R que está unido a su propio grupo amino, formando una estructura anular. Así, la prolina es una excepción a la estructura típica de un aminoácido, ya que no tiene el grupo amino habitual NH3start subscript, 3, end subscript+start superscript, plus, end superscript. Si crees que esa estructura anular se ve un poco rara, estás en lo cierto: la prolina a menudo provoca que las cadenas de aminoácidos se doblen o tuerzan.
- La cisteína contiene un grupo tiol (-SH) y puede formar enlaces covalentes con otras cisteínas. Veremos por qué esto es importante para la estructura y función de las proteínas en el artículo sobre órdenes estructurales de las proteínas
Por último, existen otro aminoácidos “no canónicos” que se encuentran en las proteínas solo en ciertas condiciones.
Enlaces peptídicos
Cada
proteína de las células consiste en una o más cadenas polipeptídicas,
cada una de las cuales se compone de aminoácidos, unidos en un orden
específico. Un polipéptido es como una palabra larga que se "deletrea"
en aminoácidos4start superscript, 4, end superscript.
Las propiedades químicas y el orden de los aminoácidos son clave en la
determinación de la estructura y función del polipéptido, y la proteína
es parte de eso. Pero, ¿cómo están los aminoácidos unidos en cadenas?
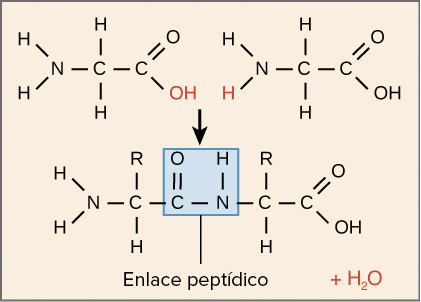
Los aminoácido de un polipéptido se unen a sus vecinos mediante un enlace covalente conocido como enlace peptídico, que se forma en una reacción de síntesis por deshidratación (condensación). Durante la síntesis de proteínas,
el grupo carboxilo del aminoácido al final de la creciente cadena
polipeptídica reacciona con el grupo amino de un aminoácido entrante,
liberando una molécula de agua. El enlace resultante entre aminoácidos
es un enlace peptídico.
Dada la estructura de los aminoácidos, una cadena polipeptídica tiene direccionalidad: tiene dos extremos distintos entre sí a nivel químico. En un extremo, el polipéptido tiene un grupo amino libre, llamado amino terminal (o extremo N-terminal). El otro extremo, que tiene un grupo carboxilo libre, se conoce como carboxilo terminal
(o extremo C-terminal). En el polipéptido muy corto ilustrado arriba,
el extremo N-terminal está a la izquierda y el C-terminal, a la derecha.
¿Cómo
pasamos de la secuencia de aminoácidos de un polipéptido a la
estructura tridimensional de una proteína madura y funcional? Para
aprender cómo las interacciones entre los aminoácidos provocan que una
proteína llegue a su forma madura, te recomendamos el video sobre órdenes estructurales de las proteínas.



0 Comments:
Publicar un comentario